Færsluflokkur: Vísindi og fræði
8.6.2013 | 16:11
Skýrslur: Primary Lateral Sclerosis
Vísindi og fræði | Breytt 7.7.2013 kl. 18:07 | Slóð | Facebook
17.5.2013 | 11:30
Kári Stefánsson: Að bjarga eða bjarga ekki mannslífum
Kári Stefánsson: Að bjarga eða bjarga ekki mannslífum. Fyrst birt í Morgunblaðinu 17. maí 2013.
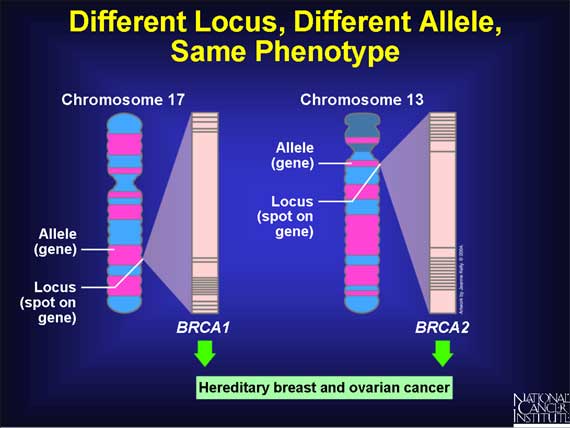
Kári Stefánsson.Vísindamenn Íslendskrar efðagreiningar hafa unnið að rannsóknum á erfðum fjölmargra sjúkdóma á síðustu sautján árum og hafa lagt töluvert af mörkum til þess fjölda meingena sem hafa uppgötvast á því tímabili. Þeir hafa einnig öðlast mikið innsæi inn í það hvernig Íslendsk erfðamengi eru samansett og gætu þar af leiðandi sagt fyrir um það með mikilli vissu hvort einstaklingar hýsi stökkbreytingar í genum sem geta leitt til illvígra sjúkdóma eins og ákveðinna krabbameina. Flest þessara krabbameina eru þess eðlis að þau deyða þann sem greinist með þau nema þau greinist snemma eða gripið sé inn í áður en þau greinast.Þar af leiðandi væri hægt að bjarga mannslífum ef hægt væri að bera kennsl á þá sem hafa stökkbreytingar sem auka líkur á þessum meinum. Ég hef bent heilbrigðisyfirvöldum á Íslandi á þann möguleika sem felst í getu okkar til þess að finna þessa arfbera en hef talað fyrir daufum eyrum eða málinu hefur verið vísað til nefnda sem hafa komist að raun um að réttast sé að gera ekkert og leyfa þessu fólki að deyja sínum drottni óáreitt vegna þess að áreitið af því að vita af hættunni vegi þyngra en möguleikinn á því að bjarga lífi þess.Þegar fræg bandarísk leikkona sem átti móður sem dó af völdum krabbameins í brjósti komst að því að hún væri með stökkbreytingu í BRCA1 sem fylgdu 87% líkur á því að hún fengi banamein móður sinnar og lét fjarlægja úr sér bæði brjóstin og sagði frá því í New York Times, spruttu upp miklar umræður um brjóstakrabbameinsgen um allan heim og ekki síst á Íslandi. Það má leiða að því rök að umræðan á Íslandi standi á þremur fótum, í fyrsta lagi staðreyndum, í öðru lagi tilfinningum og í þriðja lagi skoðunum. Skoðanirnar byggjast líklega jafnmikið á tilfinningunum og staðreyndunum og er það ekki endilega slæmt. Við getum hins vegar gengið úr skugga um að staðreyndirnar standi undir nafni eða séu réttar en tilfinningarnar og skoðanir eru bara; þær eru hvorki réttar né rangar.Vísindamenn ÍE gætu fundið í kringum 2.400 Íslendinga sem bera stökkbreytingu í BRCA2-geninu sem styttir líf kvenna að meðaltali um tólf ár og karla um þrjú. Þetta er staðreynd þrátt fyrir að landlæknir hafi látið hafa það eftir sér í viðtölum að við gætum þetta ekki. Það er að vísu rétt sem hann hefur sagt að það sé ákveðin óvissa í ákvörðun á þessu, en það á við um allar mælingar, hvort sem þær eru gerðar í tengslum við læknisfræði eða ekki. Það mætti hins vegar minnka þá óvissu niður í næstum ekki neitt með því að arfgerðargreina á nýjan leik alla þá sem við bærum kennsl á. ÍE gæti gert það fljótt og samfélaginu að kostnaðarlausu. Ef þetta væri gert mætti bjóða þeim konum sem bera BRCA2-stökkbreytinguna og eru í bráðri hættu á því að fá brjóstakrabbamein upp á nákvæmt eftirlit og jafnvel aðgerð sem gæti minnkað krabbameinshættuna niður fyrir meðaláhættu þeirra sem bera ekki stökkbreytinguna.En til þess að við getum borið kennsl á einstaklinga þarf samfélagið að vilja það og leyfi þarf að fást frá Persónuvernd og Vísindasiðanefnd. Öll gögn sem ÍE býr yfir eru á dulkóðuðum kennitölum og hefur verið aflað til þess að vinna að vísindarannsóknum, sem hafa hlotið leyfi Persónuverndar og Vísindasiðanefndar og það verða ekki borin kennsl á þatttakendur öðru vísi en í gegnum lykil sem er í forsjá Persónuverndar. Það eru einkum tvenn meginrök sem hafa heyrst gegn því að hafa beint samband við arfbera BRCA2-stökkbreytingarinnar.Í fyrsta lagi mætti leiða að því rök að það væri að vissu leyti brot á samningi milli ÍE og þátttakendanna ef gögn um þá væru notuð í klínískum tilgangi. Í annan stað eigi arfberarnir rétt á því að vita ekki hvort þeir hýsi stökkbreytinguna. Þessar röksemdir lúta annars vegar að mikilvægum rétti þátttakendanna sem eiga að ráða mestu um það hvernig upplýsingar um þá eru notaðar og hin að mikilvægum rétti okkar allra til þess að hafa val um það hverju er snúið að okkur.Í báðum tilfellum er um að ræða mikilvægan rétt en í hvorugu tilfellanna rétt sem er án vafa mikilvægari en allt annað. Ég held því fram að í báðum tilfellum sé um að ræða rétt sem er trompaður af mikilvægi þess að geta bjargað lífi arfberanna sem eru í geigvænlegri hættu. Þetta er mín skoðun sem ég styð til dæmis með tveimur röksemdum, annarri úr siðfræðinni og hinni úr hefð í Íslendsku samfélagi.Siðfræðiröksemdin: Ein af þeim spurningum sem siðfræðingar nota oft sem dæmi um skyldur sem á okkur hvíla er hvort að sá maður sem hrindi öðrum fram af bryggjunni þannig að hann drukkni sé sekari en sá sem stendur aðgerðarlaus á bryggjusporðinum og horfir á annan mann drukkna sem datt í sjóinn af eigin rammleik. Svarið er oftast að það sé í sjálfu sér ekki mikill munur. Okkur ber skylda til þess að bjarga lífi ef við getum það þótt það megi sjálfsagt deila um það hversu mikla áhættu okkur beri að taka við björgunina. Samkvæmt þessu bæri þátttakendunum í rannsóknum ÍE skylda til þess að bjarga lífi arfberanna og réttur þeirra til þess að takmarka notkun gagnanna hlyti að víkja. Í þessu tilfelli væri áhættan sem þátttakendurnir tækju nákvæmlega engin.Dæmi úr Íslendsku samfélagi: Ef rjúpnaskytta skilar sér ekki heim að kveldi sendum við leitarflokka eftir henni án þess að spyrja hana leyfis þótt reynslan sýni að það séu töluvert minni líkur á því að hún verði úti en að arfberi BRCA2-stökkbreytingar deyi úr brjóstakrabbameini. Þetta gerum við vegna þess að okkur þykir réttur skyttunnar til þess að taka sjálf ákvörðun um framvindu mála léttvægur miðað við nauðsyn þess að koma henni til byggða. Við merkjum sígarettupakka með hótunum um dauða eða alvarlega sjúkdóma þótt ekki séu nema 14,5% líkur á því að einstaklingur sem reykir til langframa fái lungnakrabbamein og við brjótum þar með rétt þeirra reykingamanna sem ekki vilja vita. Þetta gerum við vegna þess að við vonumst til þess að með því að brjóta þennan rétt á hundrað prósentum reykingamanna getum við fækkað þeim og þar með minnkað þann fjölda sem felst í þessum 14,5%.En BRCA2 er ekki eina dæmið um erfðavísi með stökkbreytingu sem eykur mjög hættuna á banvænum sjúkdómi sem við gætum auðveldlega staðsett meðal Íslendinga og á þann máta búið til forsendur fyrir því að bjarga mannslífum. Taflan hér að neðan er með sex dæmi úr krabbameinsheiminum. Við erum þar að auki með mýmörg slík dæmi úr annars konar sjúkdómum. |
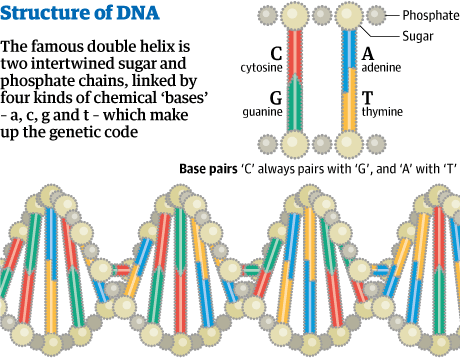
DNA double helix: discovery that led to 60 years of biological revolution. Birtist fyrst hjá The Guardian 25. apríl 2013.
Adam Rutherford.On 25 April 1953, Francis Harry Compton Crick and James Dewey Watson published a paper in Nature describing the double helix structure of DNA.The myth is that science proceeds in fits and starts, with eureka moments delivering revelation and revolution. The reality is usually much more mundane: a case of scientists grinding out small, incremental advances. But the publication 60 years ago of Francis Crick and James Watson's celebrated structure of DNA – the twisted ladder of the double helix – can legitimately be regarded as a turning point: our understanding of life was changed forever that day, and the modern era of biology began."It has not escaped our notice," they wrote in a brief paper in the journal Nature, that the double helix "immediately suggests a copying mechanism for the genetic material." And so it does. This elegant spiral, first drawn by Crick's wife Odile, depicts life's most famous molecule. Nowadays it is part of our culture: in films, as art, on shampoo adverts. We now know that DNA is a dynamic, tortuous coil, constantly shuffling and unwinding, bustling with activity as it enacts its many programs.Since 1953, biology has evolved into a global industry, with our ever-increasing command over DNA at its core. We have seen the emergence of genetic modification and now synthetic biology – for both scientific and commercial gain – each with its own mire of ongoing legal wrangles. And now we are entering the post-DNA era. In the past couple of years, the nature of DNA itself has been modified, its alphabet mutated and its function reinvented for non-biological uses.DNA's operation is determined by its shape. Each rung of the ladder is made up of a pair of two of the four letters of the DNA alphabet – A, T, C and G. But A will only pair with T, and C only with G. So if you were to split the ladder in two, breaking the paired rungs, then on each of these struts you would have all the information needed to replace the missing one. Hence, from one DNA molecule, you can make two identical molecules. This is happening right now inside you as the cells that make up your body divide, at a rate of around 3,000 letters a minute (bacteria can do it 10 times faster). And the same process has been happening continuously in every cell that has ever existed on Earth. DNA in living cells, as far as we know, is universal, and combined with Darwin's theory of evolution we have a robust model of how life is, and how it came to be, its origins almost 4bn years ago.DNA is a code, a means of storing biological data, in the form of genes. The code was systematically cracked in the 1960s, revealing that life is breathtakingly conservative. If DNA is an alphabet, then the words it spells out are amino acids, the building blocks of proteins. And yet only 20 amino acids are encoded by DNA in all life forms. The same alphabet, the same encryption, the same lexicon are applied in every bacterium or blue whale, in you, a sunflower and a mushroom.It is this uniformity that spawned the industrial revolution of biotechnology that we are in the throes of today. In California in the early 1970s, scientists invented ways to swap chunks of DNA between species, so that they acquired specific characteristics by design. Humans have been doing something similar for 10,000 years through breeding and farming, but with the advent of DNA editing tools, we were suddenly no longer bound by the limitations of creatures that could have sex. Genetic modification has become a mainstay of almost every aspect of the life sciences, and provided innumerable advances in our understanding of how life and diseases work. |
15.4.2013 | 21:28
Myriad Genetics CEO Claims He Owns Your Genes
Myriad Genetics CEO Claims He Owns Your Genes. Birtist fyrst hjá Forbes 13. apríl 2013.
Steven Salzberg.With the Supreme Court about to hear a landmark case on gene patents, Myriad Genetics, the company that owns the patents under scrutiny, is going on the offensive. I’ve written about this case before, when the patents were first thrown out by one court, and then restored by another. Now the Supremes will have the final say.Just last week, geneticists Jeffrey Rosenfeld and Chris Mason wrote a commentary for the Washington Post that warned about the consequences of companies owning the rights to our gene sequences.Today, in a letter filled with non sequiturs and distortions, Myriad Genetics’ CEO Peter Meldrum, worried about whether his company will be able to maintain their monopoly on a test for which they charge $4000, responded. Let’s look at his claims. |
Vísindi og fræði | Breytt 30.4.2013 kl. 11:26 | Slóð | Facebook
12.4.2013 | 11:27
Erfðafræðibyltingin er tækifæri fyrir Ísland
Erfðafræðibyltingin er tækifæri fyrir Ísland. Birtist fyrst í Morgunblaðinu 12. apríl 2013.
Bjarni Jóhann Vilhjálmsson.Árið 2000 tilkynntu Bill Clinton og Tony Blair sameiginlega að fyrsta erfðamengi mannsins hefði verið raðgreint. Meira en áratug tók að ljúka þessu gríðarlega stóra verkefni og kostnaður við það er nú talinn hafa numið um þremur milljörðum dollara (375 milljörðum króna). Þessu er réttilega lýst sem einhverju mikilvægasta vísindaafreki mannkyns sem markaði tímamót í lífvísindum.Margar góðar ástæður voru fyrir því að ráðast í þetta stóra verkefni á sínum tíma. Með erfðamengi mannsins í hendi var hægt að öðlast dýpri skilning á líffræði og ennfremur erfðum algengra sjúkdóma og þannig þróa nýjar meðferðir og lyf gegn sjúkdómum. Annar stór ávinningur var möguleikinn á einstaklingsbundnum lyfjum og læknismeðferðum þar sem erfðir eru hafðar að leiðarljósi við meðhöndlun sjúkdómsins. Brátt kom þó í ljós að erfðir algengra sjúkdóma voru flóknari en flestir höfðu spáð. Nýju lyfin og persónulegu læknismeðferðirnar hafa því ekki orðið eins fljótt að veruleika og sumir vísindamenn gerðu upphaflega ráð fyrir. Nú eru þó teikn á lofti um að það muni brátt breytast.Á undanförnum árum hefur orðið önnur, en þó hljóðlátari, bylting í erfðafræði. Þessi bylting hefur verið knúin áfram af gríðarlegum tækniframförum í raðgreiningu erfðamengja. Kostnaður við að raðgreina einstök erfðamengi einstaklings er nú u.þ.b. 5.000 dollarar (625 þús. kr.) og það tekur innan við viku að ljúka greiningunni. Með því aðeins að greina breytilega hluta erfðaefnis einstaklinga er hægt að fá mjög heildstæða mynd af erfðamenginu fyrir mun minni upphæð, eða 99 dollara (12.500 kr.), sem er það verð sem líftæknifyrirtækið 23andme (https://www.23andme.com/) tekur fyrir að erfðagreina einstakling. Þetta er ótrúlegt í ljósi kostnaðarins fyrir 13 árum þegar Bill Clinton og Tony Blair tilkynntu hið mikla vísindaafrek. Þessi bylting hefur leitt til ástands sem líkist kannski mest upphafi internetsins í byrjun tíunda áratugar seinustu aldar, þegar allir þeir möguleikar sem internetið bauð upp á voru enn ókannaðir.Hvað þýðir þetta fyrir læknisfræði framtíðarinnar? Nú er loksins hægt að öðlast nokkuð heildstæða mynd af erfðum algengra sjúkdóma með því að raðgreina tugi þúsunda einstaklinga. Þetta hefur opnað fyrir lyfjaþróun fyrir skilvirkari og nákvæmari lyfjameðferðir sem taka mið af erfðaefni einstaklinga. Bættur skilningur á erfðum sjúkdóma gerir okkur einnig kleift að bæta núverandi spálíkön fyrir sjúkdóma, en nú er nánast einungis tekið mið af þekktum áhættuþáttum og sjúkdómstíðni meðal náinna fjölskyldumeðlima. Að geta einnig tekið mið af bæði ætterni og erfðaefni einstaklinga getur því haft víðtæk áhrif á lífslíkur og lífsgæði einstaklinga. Þetta á t.d. við um hjartaáföll, offitu, alzheimer, sykursýki, gláku og marga aðra arfgenga sjúkdóma þar sem ingrip í tæka tíð geta skipt miklu máli.Af hverju er þetta ekki gert? Aðalástæðan er líklega sú að tæknin er of ung og hefur enn ekki áunnið sér traust. Ísland er reyndar sérstaklega vel í stakk búið til þess að koma þessari tækni í notkun innan núverandi heilbrigðiskerfis. Samtök og fyrirtæki á borð við t.d. Hjartavernd og Íslenska erfðagreiningu, sem og aðrir sérfræðingar á Íslandi, eru með framúrskarandi kunnáttu á þessu sviði sem er vel þekkt í hinu alþjóðlega vísindaumhverfi. Í mínum huga er þetta aðeins spurning um hvort við viljum vera meðal þeirra fyrstu til þess að nýta okkur þessa nýju tækni innan heilbrigðisþjónustunar eða ekki. Ég tel að við eigum að grípa þetta einstaka tækifæri strax og vera í fararbroddi í erfðafræðibyltingu innan heilbrigðisþjónustunnar þar sem skynsemi og eðlileg siðferðisleg sjónarmið eru höfð í heiðri.
|
28.3.2013 | 14:35
Rannsókn á genum MND sjúklinga á Íslandi afsannar ætlaðan sjúkdómsvald
Rannsókn á genum MND-sjúklinga á Íslandi afsannar ætlaðan sjúkdómsvald. Birtist fyrst í Morgunblaðinu 28. marz 2013.
Loftur Altice Þorsteinsson.MND er hreyfitauga-sjúkdómur, sem herjar á allar þjóðir í svipuðum mæli. Engin lækning hefur fundist við sjúkdómnum, sem fer versnandi er tíminn líður og leiðir oftast til dauða sjúklinganna. Orsakir MND eru taldar vera gena-breytingar sem valda göllum í prótínum. Um 20 slík gen hafa verið greind, en gena-breytingar sem koma við sögu skipta hundruðum. Til að finna lækningu við MND, er ljóslega mikilvægt að greina rétt hvaða gena-breytingar valda sjúkdómnum. Sjúklingar og læknar á Íslandi hafa komið að mikilvægum rannsóknum á þessu sviði.MND-sjúkdómurinn getur bæði verið ættgengur og tilfallandi. Þótt einungis um 10% sjúklinga séu með ættgengt afbrigði sjúkdómsins, er sá hópur ákaflega mikilvægur vegna þess að hjá honum hafa greinst langflestar gena-breytingar sem taldar eru vera orsök sjúkdómsins. Allar stökkbreytingar hjá fólki eru að meðaltali taldar vera um 60 og eru sumar þeirra orsök sjúkdóma en aðrar kunna að vera gagnlegar fyrir heilsufar fólks og jafnvel æskilegar fyrir þróun mannkyns. Eina stökkbreytingin sem greinst hefur hérlendis og öruggt má telja að valdi ættgengu afbrigði MND-sjúkdómsins nefnist G93S-SOD1.Lífvísindamenn í Umeå, Svíþjóð munu bráðlega birta skýrslur um mikilvæga rannsókn, sem varðar gen sem nefnt er VAPB. Þetta gen hefur verið tengt MND frá 2004, í framhaldi af rannsókn sem gerð var í Brasilíu. Síðari rannsóknir hafa flestar dregið þessi tengsl í efa. Auk Svía, komu að rannsóknunum taugalæknar frá Íslandi (Grétar Guðmundsson) og Portúgal. Einn þessara vísindamanna (Caroline Ingre) kemur til landsins og heldur fyrirlestur í Háskóla Íslands 02. apríl næstkomandi.Rannsóknir á gena-breytingum með þátttöku MND-sjúklinga.MND-sjúklingar á Íslandi hafa verið duglegir við að fá sjúkdóm sinn rannsakaðann. Í þeirri rannsókn sem Svíarnir stjórnuðu tóku þátt 19 sjúklingar á Íslandi, 126 í Portúgal og 973 í Svíþjóð. Auk þess voru notuð blóðsýni til samanburðar frá 644 manneskjum. Hjá 14 Sænskum sjúklingum og 9 heilbrigðum frá Svíþjóð og Portúgal fundust fimm VAPB-breytingar, þar af voru tvær áður óþekktar. Sjúklingarnir 14 með VAPB-breytingarnar höfðu allir verið greindir með afbrigði af MND, sem nefnist ættgengt ALS. VAPB-breytingar fundust jafnframt hjá heilbrigðum ættingjum þeirra.Stökkbreytingin A130G-VAPB fannst einnig hjá tveimur sjúklingum, sem tilheyra ALS-greindri fjölskyldu á Íslandi, en breytingin tengist ekki sjúkdómnum, því að hinir sjúklingarnir héðan eru ekki með VAPB-breytinguna. Hins vegar reyndust allir sjúklingarnir frá Íslandi vera með stökkbreytingu í SOD1-geni, sem nefnist G93S. Sjúkdómseinkenni allra þessara sjúklinga eru eins, þannig að dreginn er sú ályktun að stökkbreytingin G93S-SOD1 valdi sjúkdómnum. Þess má geta að G93S-SOD1 hefur einungis fundist hjá MND-sjúklingum í Japan, fyrir utan Ísland.Rannsóknin leiddi í ljós, að VAPB-breytingar voru jafn algengar hjá MND-sjúklingunum eins og hjá öðru fólki í rannsókninni. Að auki fannst VAPB-breyting hjá nokkrum heilbrigðum ættingjum MND-sjúklinga. Þetta atriði, ásamt því að engin fylgni sjúkdómsins verður greind með VAPB-breytingum, veldur því að mjög ólíklegt er að VAPB-breytingar valdi MND-sjúkdómnum.Ein af niðurstöðum rannsóknarinnar sem hér hefur verið nefnd, er að mikilvægt er að gena-greina fleirri en bara viðkomandi sjúkling. Greiningin verður einnig að ná til nákominna ættingja hans. Röng gena-greining getur haft alvarlegar afleiðingar fyrir fleirri en sjúklinginn. Ættingar hans geta þurft að fara í greiningu síðar vegna sjúkdómseinkenna, eða fjölskylduáætlana. Almennt er röng sjúkdómsgreining á meðal þess erfiðasta sem sjúklingar lenda í, hvaða sjúkdóm sem um er að ræða.Félag stofnað um MND-rannsóknir á Íslandi.Alþjóðleg miðstöð MND-rannsókna var stofnuð 08. nóvember 2012 og er hugsjónafélag, sem verja mun öllum rekstrarhagnaði til rannsókna. Tilgangur þess er að stuðla að rannsóknum á hreyfitauga sjúkdómum, í samstarfi við erlendar og innlendar vísindastofnanir. Verkefnin eru fólgin í nákvæmri sjúkdómsgreiningu MND-sjúklinga á Íslandi, rannsóknum á orsökum hreyfitauga sjúkdóma og leitar að lækningu á þeim.Nú þegar hefur tekist traust samband við nokkrar erlendar rannsóknar-stofnanir, á sviði hreyfitauga sjúkdóma. Geta má sérstaklega eftirfarandi prófessora í taugalækningum, sem eru virkir í rannsóknum: Peter Munch Andersen, við Háskólann í Umeå, Svíþjóð, John K. Fink, við Háskólann í Michigan, Bandaríkjunum, Guy A. Rouleau, við Háskólann í Montreal, Kanada. Þar til fjármögnun hefur tekist til innlendra rannsókna, mun félagið senda lífsýni til erlendra samstarfsmanna.Félagið óskar eftir nánu samstarfi við félagasamtök fólks með hreyfitauga sjúkdóma, heilbrigðisyfirvöld, heilbrigðisstofnanir, rannsóknar-stofnanir á sviði líffræði og sjálfstætt starfandi vísindamenn. Félagið hefur sótt um fjárframlag frá ríkisstjórn Íslands, en verið hafnað. Vonir standa til að nærsta ríkisstjórn verði vinveittari MND-rannsóknum.><<>><
|
Vísindi og fræði | Breytt 30.3.2013 kl. 08:54 | Slóð | Facebook
27.2.2013 | 17:18
Hreyfitauga sjúkdómar og batahorfur MND-sjúklinga
Hreyfitauga sjúkdómar og batahorfur MND-sjúklinga. Birtist fyrst í 20 ára afmælisblaði MND-félagsins 20. febrúar 2013.
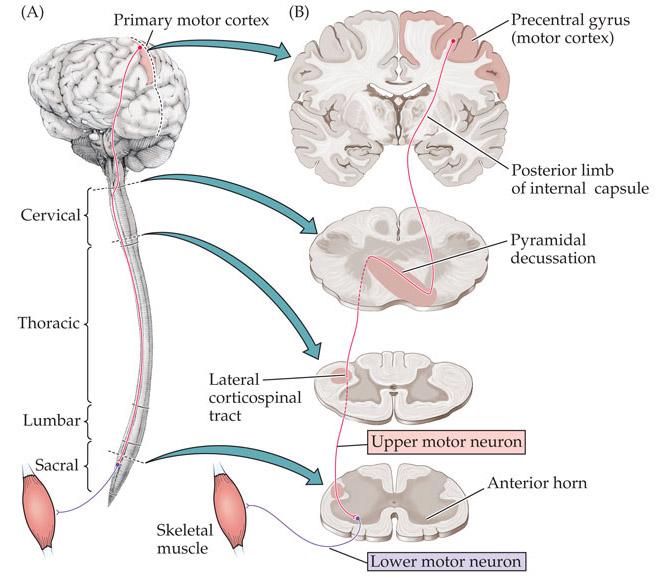
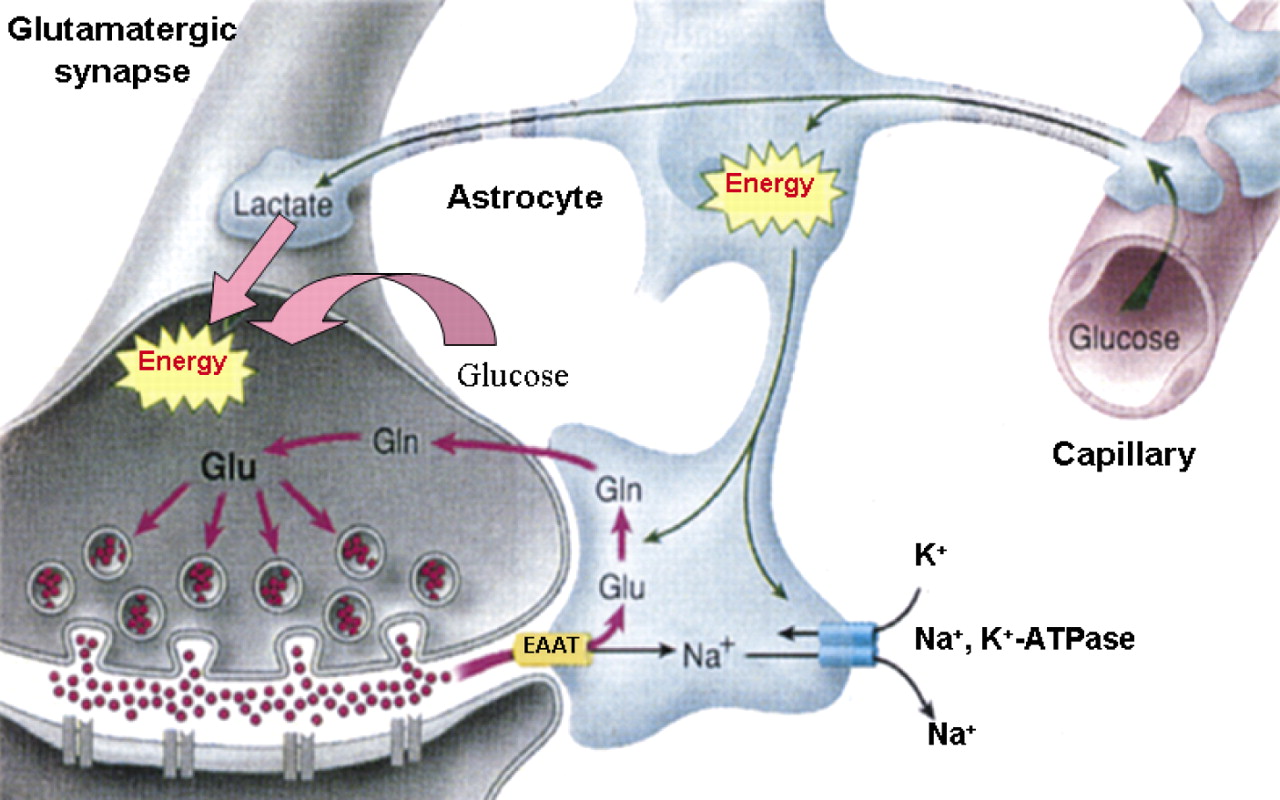
Loftur Altice Þorsteinsson.Hreyfitauga sjúkdómar (MND) er samheiti yfir sjúkdóma, sem eiga það sameiginlegt að hreyfitaugar visna eða missa fulla virkni, með þeirri afleiðingu að viljastýrðir vöðvar líkamans hætta að starfa eðlilega. Um er að ræða margvísleg sjúkdómseinkenni og greindar hafa verið margar orsakir. Í alvarlegustu afbrigðum MND visna vöðvarnir, þegar hreyfitaugarnar bera þeim ekki lengur rafboð frá heilanum. Í öðrum afbrigðum verða vöðvarnir stífir og taugaviðbrögð hörð og ósjálfráð, þrátt fyrir að heilinn haldi sambandi við vöðvana. Sem dæmi um þessi mismunandi afbrigði MND (motor neuron disease) má nefna ALS (amyothophic lateral sclerosis) og PLS (primari lateral sclerosis).Sjúklingum sem greinast með MND verður fljótt ljóst, að sjúkdómur þeirra er talinn vera ólæknandi, versna stig af stigi og vera banvænn. Meðaltölin eru ekki uppörvandi, en þegar farið er að skoða málið ofan í kjölinn, koma í ljós staðreyndir sem gefa meðaltölunum langt nef. Fólk upplifir sig ekki sem meðaltöl, heldur sem sérstaka einstaklinga í sínum sérstöku kringumstæðum. Þeir sem ekki falla fljótt fyrir sjúkdómnum, geta gert sér vonir um að lifa lengi með honum, þótt batahorfur séu vissulega ennþá litlar.Hægt er að benda á, að frá því að fyrstu einkenni koma í ljós lifa um 40% sjúklinga lengur en 5 ár, um 20% lifa lengur en 10 ár og um 10% sjúklinga lengur en 20 ár. Jafnvel »kraftaverk« geta skeð, því að hjá um 5% sjúklinga virðist sjúkdómurinn fjara út, að því marki að hann nær ekki útbreiðslu til allra viljastýrðra vöðva. Þegar bætist við, að rannsóknir á MND eru víða um lönd stundaðar af kappi, er ekki gefið að MND-sjúklingar gefi sig á vald örvæntingar.Lífslengd sjúklinga með MND er þannig ákaflega mismunandi og sama á við um einkenni sjúkdómsins, að þau eru margbreytileg. Þessi breytileiki stafar af því að MND er ekki einsleitur sjúkdómur, heldur hefur mörg birtingarform. Hann er talinn stafa af stökkbreytingu í genum sem stjórna gerð og starfsemi mismunandi prótína í hreyfitauga-kerfi sjúklinga. Stökkbreyttu prótínin er að finna í heilaberki og mænu. Veikindin birtast síðan í hrörnun hreyfitauganna: a) efri hreyfitauga, sem liggja frá heilaberki niður mænuna og b) neðri hreyfitauga, sem liggja frá mænunni út í viljastýrða vöðva í fótum, bol, höndum og höfði.Þótt hreyfitauga-frumur hjá MND-sjúklingum verði hrörnun að bráð, er ekki ljóst hvað veldur þessari hrörnun. Einn möguleiki er að orsökin sé orkuskortur hjá hreyfitaugunum og að þær verði þess vegna ófærar að flytja boð að og frá viljastýrðu vöðvunum. Vitað er að svo nefndar stjörnufrumur (astrocytes), sem finnast í taugakerfinu, gegna meðal annars því verkefni að bera hreyfitaugunum orku. Stjörnufrumurnar tengjast bæði blóðæðum og hreyfitaugum og breyta orku-ríkum glúkosa (glucose) úr blóðinu í mjólkursýru (lactate) sem þær færa hreyfitaugunum. Rannsóknir hafa sýnt að stökkbreytt SOD1 í stjörnufrumunum kemur við sögu í MND og hugsanlega veldur það röskun á orkuflutningi til hreyfitauganna. |
21.12.2012 | 09:13
Stökkbreytta genið SOD1-G93S (fundið hjá MND-sjúklingum á Íslandi og Japan)
|
Vísindi og fræði | Breytt 8.6.2013 kl. 15:58 | Slóð | Facebook
19.12.2012 | 17:34
Vesicle traffic defects in the wobbler mouse- and human ALS patients skin fibroblasts
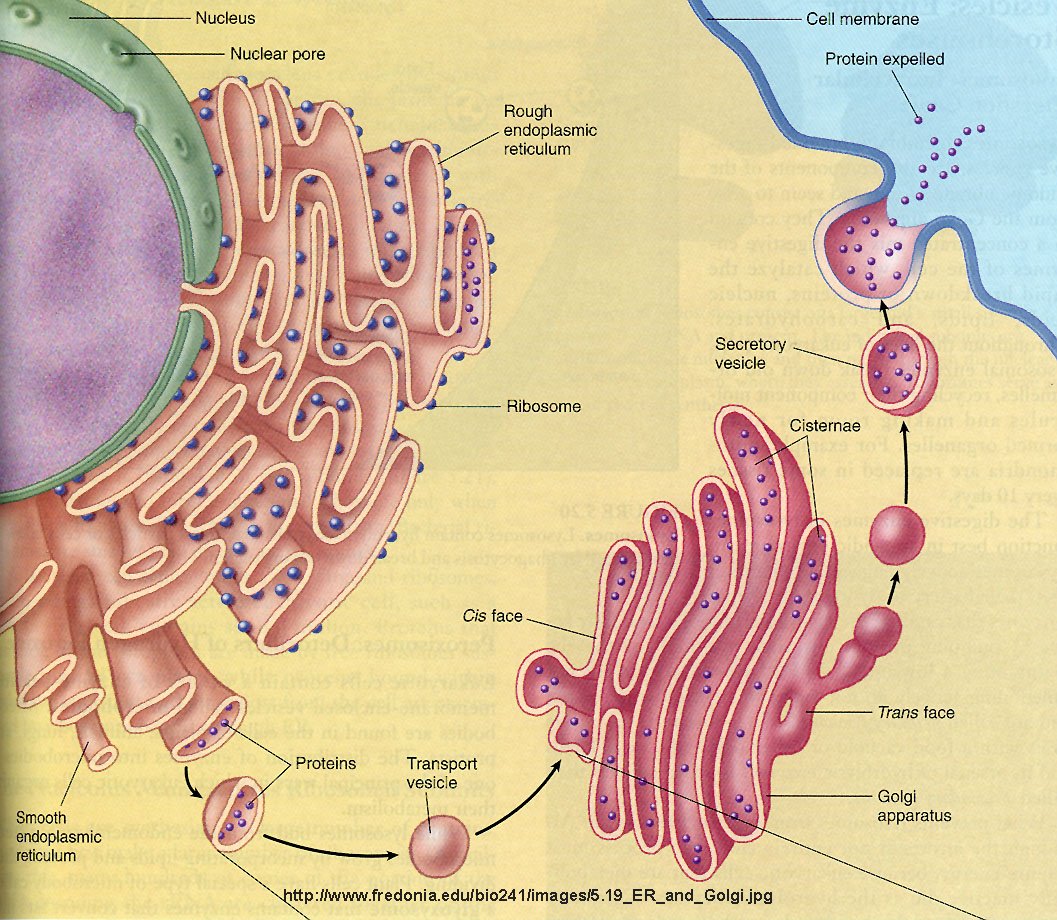
Vesicle traffic defects in the wobbler mouse- and human ALS patients skin fibroblasts. Páll Ragnar Karlsson. Þetta er úrdráttur úr fyrirlestri, sem höfundur hélt á fundi hjá MND-félaginu á árinu 2010. Byggði fyrirlesturinn á M.Sc. skýrslu höfundar, sem hann lauk við í júní 2009. Höfundur mun ljúka Ph.D. námi frá Aarhus háskóla í byrjun árs 2013. ><<>>< Tilgangur rannsóknarinnar var að koma á fót skimunarprófi fyrir galla í frumuflutningum í frumurækt frá músa-húðfíbróblöstum og mennskum ALS sjúklingum. Hugsunin á bak við rannsóknina byggist á blöðrum í frumum sem flytjast milli svæða. Hugsanlegt er að galli í flutningunum sé úrslitaþáttur fyrir hreyfitaugasjúkdóma líkt og MND. Rannsóknarhópurinn sem ég var hluti af hafði áður séð þennan galla í músafósturvísum. Hér könnuðum við hvort við myndum sjá sama galla í húðfíbróblöstum wobbler músa (dýramódel fyrir MND sjúkdóminn, þ.e. mús sem er með flestöll helstu einkenni hinn mennska MND sjúkdóms), og að hefja rannsóknir frá húðfrumum MND sjúklinga. Skimunarprófinu sem komið var á fót gengur út á eiturefna-upptöku og útbreiðslu mannósa-6-fosfat sameindarinnar. Ný prótein eru búin til í frymisnetinu (sjá mynd, rough/smooth endoplasmic reticulum). Próteinin eru svo flutt frá slétta frymisnetinu yfir í cis-enda golgi kerfisins í flutningsbólum. Próteinin fara svo í gegn um golgi kerfið og því lengra sem þau fara inn í golgi kerfið, þroskast próteinin og fara svo loks úr golgi kerfinu á trans-hliðinni sem fullþroska prótein. Próteinin eru svo annað hvort nýtt innan frumunnar eða þau flutt út úr frumunni til að sinna verkum sínum. Það er galli í þessum flutningum sem fundist hefur í frumum wobblermúsa-fósturvísa. Hægt er að kanna hvort flutningsleið próteina á milli þessara tveggja mikilvægu frumulíffæra sé í lagi með því að láta frumurnar taka upp eitur frá kólerubakteríunni. Þegar frumurnar taka eitrið upp ferðast það vanalega í gegn um golgi kerfið líkt og prótein og á að fara út trans megin. Með því að merkja golgi kerfið með einum lit og kólerueitrið með öðrum er hægt að sjá bæði staðsetningu golgi kerfisins og eitursins með smásjá sem kölluð er confocal smásjá. Tilraunirnar voru gerðar í frumutækt. Það er að segja húðsýni voru tekin úr heilbrigðum músum og wobblermúsum ásamt fjórum MND sjúklingum og tveimur heilbrigðum ættingjum eins þeirra. Frumur voru síðan ræktaðar út frá þessum sýnum til þess að gera tilraunir á. Á myndinni fyrir neðan má sjá dæmi um hvernig litun í eiturefnaprófi mannafruma lítur út. Á myndinni eru frumur sem hafa fengið að taka upp kólerueitrið (grænt) í 20 mínútur og á að vera í og við golgi kerfið (rautt). Efri myndalínan sýnir heilbrigðar frumur en sú neðri frumur frá MND sjúklingi. Það er erfitt að dæma aðeins út frá myndunum hvort það sé meira eitur við golgi kerfið, þar sem það á að vera ef allt sé eðlilegt, hjá MND sjúklingnum eða hjá heilbrigða ættingjanum. Út frá vísindalegu sjónarmiði er það heldur ekki nægjanlegt að skoða einungis myndirnar. Það þarf að mæla á einhvern hátt hversu hátt hlutfall af því eitri sem er komið inn í frumuna, er í golgi kerfinu. Það er gert í confocal smásjánni. Hún getur talið alla þá grænu punkta sem eru inn í frumunni – einnig þá sem eru í rauðu punktunum. Tölvan reiknar svo út hlutfall grænna punkta í rauðum punktum og kemur út með tölu frá 0 og upp í 1, þar sem 0 merkir að ekkert eitur er í golgi kerfinu (0%) og 1 merkir að allt eitrið sem er inni í frumunni er staðsett í golgi kerfinu (100%). Niðurstöður þessara mælinga má sjá á myndunum á næstu síðu. Vinstri hliðin sýnir niðurstöður mælinganna fyrir mýsnar og hægri myndin niðurstöður fyrir mennsku frumurnar. Bláu súlurnar eru heilbrigðar mýs og menn á meðan aðrir litir (hægra megin við bláu súlurnar) eru MND sjúkar (wobbler) mýs og MND sjúklingar. Tveir heilbrigðir einstaklingar voru mældir hjá mönnunum og eru um 20 mælingar á bak við hverja súlu. Á X ásnum (lárétt) er tími í mínútum en á Y ásnum (lóðrétt) er magn eiturs mælt í golgi kerfinu (0.1 = 10% af eitrinu er í golgi kerfinu). Niðurstöðurnar hjá músunum sýna að það er stærðfræðilega marktækur munur á eitri í golgi kerfinu milli músategundanna eftir 10 mínútna upptöku og síðar (mælt var eftir 5, 10, 20 og 40 mínútur), táknað með stjörnu. Þegar MND sjúklingarnir og heilbrigðu ættingjarnir eru bornir saman sést stærðfræðilega marktækur munur eftir 5, 20 og 40 mínútur en einhverra hluta vegna ekki eftir 10 mínútur. Önnur próf voru einnig gerð, til dæmis var kannað hvar sameindin mannose-6-fosfat er til staðar í frumunum. Ef allt er eðlilegt á sameindin að vera í og við golgi-kerfið. Sé golgi kerfið hins vegar bilað eða ekki til staðar er sameindin á víð og dreif í frumunni. Rannsóknir okkar sýna að sameindin sé meira dreifð hjá wobbler músafrumunum en hjá heilbrigðu músafrumunum. Einnig gerðum við frumuátspróf þar sem við útilokuðum að sjúku frumurnar ættu erfiðara með að taka upp eitur og efni frá umhverfi sínu en heilbrigðu frumurnar. Frumurnar eiga jafn auðvelt með að taka eitrið upp. Helstu niðurstöður okkar eru að flutningsgallar eru séðir í húðfrumum músafósturvísa, fíbróblöstum úr húð wobbler músa og (amk hér) ALS sjúklinga með SOD1 stökkbreytinguna. Meirihluti MPR gæti verið á röngum stöðum í frumunum, hugsanlega vegna MPR uppsöfnunar í litlum flutningsbólum fyrir neðan svokölluð endosome (Pérez-Victoria, 2008) eða vegna umferðarstíflu við trans golgi kerfið; þau sameinast hvort öðru, sem leiðir til stórra endosomal sameinda (Schmitt-John, P. Karlsson). Að lokum tókst að setja á fót hagnýtt skimunarpróf til að auðkenna galla í frumuflutningum. Við athuguðum þó aðeins fjóra MND sjúklinga og tvo heilbrigða ættingja eins þeirra. Frekari prófanir þarf því að gera á frumum frá MND sjúklingum. Þá gætum við hafa kynnt fyrstu skrefin að mögulegum meðferðum þar sem hægt er að nota skimunarprófið fyrir lyfjafræðilegri skimun að sameindum með gagnleg áhrif á frumuflutninga. ><<>>< |
Vísindi og fræði | Breytt s.d. kl. 17:39 | Slóð | Facebook
17.12.2012 | 09:35
Fréttatilkynning um stofnun Alþjóðlegrar miðstöðvar MND-rannsókna
Fréttatilkynning 15. desember 2012. Alþjóðleg miðstöð MND-rannsókna var stofnuð 08. nóvember 2012 og er hugsjónafélag, sem verja mun öllum rekstrarhagnaði til rannsókna. Tilgangur þess er að stuðla að rannsóknum á hreyfitauga sjúkdómum, í samstarfi við erlendar og innlendar vísindastofnanir. Verkefnin eru fólgin í nákvæmri sjúkdómsgreiningu MND-sjúklinga á Íslandi, rannsóknum á orsökum hreyfitauga sjúkdóma og leitar að lækningu á þeim. Félagið mun hafi náið samstarf við félagasamtök fólks með hreyfitauga sjúkdóma, heilbrigðisyfirvöld, heilbrigðisstofnanir, rannsóknar-stofnanir á sviði líffræði og sjálfstætt starfandi vísindamenn. Að sjálfsögðu mun félagið einnig hafa náið samráð við Persónunefnd og Vísindasiðanefnd. Hreyfitauga sjúkdómar þekkja engin landamæri og litlu skiptir hvar í heiminum þekkingar á þeim er aflað. Fjármagns til verkefna á vegum félagsins verður leitað bæði innanlands og utan. Nú þegar hefur tekist traust samband við nokkrar erlendar rannsóknar-stofnanir, á sviði hreyfitauga sjúkdóma. Geta má sérstaklega eftirfarandi vísindamanna: · Peter Munch Andersen, prófessor í taugalækningum við Háskólann í Umeå, Svíþjóð. · Chantal Tallaksen, prófessor í taugalækningum við Háskólann í Osló, Norvegi. · John K. Fink, prófessor í taugalækningum við Háskólann í Michigan, Bandaríkjunum. Félagið auglýsir eftir vísindamönnum til starfa við rannsóknir á hreyfitauga sjúkdómum og munu þeir hafa starfsaðstöðu bæði hér heima og erlendis. Félagið hefur einnig möguleika, að styrkja námsmenn í doktorsnámi, enda vinni þeir að verkefnum á sviði hreyfitauga sjúkdóma. Í stjórn félagsins eru: Loftur Altice Þorsteinsson, verkfræðingur. Sími:5887766. Grétar Guðmundsson, taugalæknir MND-teymis Landsspítala. Pétur Henry Petersen, taugalíffræðingur og lektor við Háskóla Íslands. Páll Ragnar Karlsson, sameindalíffræðingur, Háskólasjúkrahúsið í Aarhus, Danmörku. Íslendingar sem sóttu MND-ráðstefnu í Chicago í desember 2012 ><<>>< |
Vísindi og fræði | Breytt s.d. kl. 18:03 | Slóð | Facebook